
AZF - jeden z najważniejszych czynników genetycznych uwarunkowań niepłodności męskiej.

AZF - jeden z najważniejszych czynników genetycznych uwarunkowań niepłodności męskiej.
Hubert Salamaga, Tadeusz Pietrucha, Instytut Genomiki i Medycyny Molekularnej, Centrum Medycyny Spersonalizowanej CODE sp. z o.o., Łódź.
Szacunkowe dane wskazują, że w krajach wysoko rozwiniętych i rozwijających się ok. 15% par jest dotkniętych zaburzeniami płodności skutkującymi brakiem ciąży. Uważa się, że w przypadku 50% wśród tej grupy niemożność zajścia w ciążę jest wynikiem zaburzeń płodności mężczyzny [1,2].
Od 15 do 30 % przypadków męskiej niepłodności ma podłoże w zaburzeniach genetycznych [2]. Jedną z najczęściej identyfikowanych wad genetycznych w przypadku niepłodności u mężczyzn są mikrodelecje (utrata części chromosomu mniejsza niż 5 milionów par zasad) w obrębie długiego ramienia chromosomu Y w regionie AZF, [1].
Określenie AZF (Azoospermia factor – z ang. Czynnik azoospermii) odnosi się do genów występujących w regionie długiego ramienia chromosomu Y (Yq11) nazywanego regionem AZF [3]. Delecje i mikrodelecje występujące w obrębie tego regionu zostały powiązane z występowaniem azoospermii i oligozoospermii u mężczyzn [4,11].
W obrębie regionu AZF możemy wyodrębnić subregiony AZFa (nazywany również AZF1), AZFb oraz AZFc (razem określane jako AZF2) [1,3]. Na poniższym schemacie (ryc.1.) przedstawiono położenie poszczególnych subregionów AZF na chromosomie Y oraz innych regionów potencjalnie związanych z niepłodnością. Regiony AZFb i AZFc częściowo się nakładają, stąd też niektórzy autorzy wyróżniają ten “wspólny” region jako czwarty, nazywając go regionem “d” (AZFd) [12,13]. W niektórych przypadkach mężczyźni dotknięci mutacjami w regionie AZF mogą skorzystać z technologii takich jak TESE (testicular sperm extraction – pobranie plemników z jąder) a następnie ICSI (intracytoplasmic sperm injection – docytoplazmatyczna iniekcja plemników). Są to procedury zapłodnienia pozaustrojowego polegające na wprowadzeniu plemnika do wnętrza komórki jajowej. Metoda ta nie może być zastosowana w przypadku azoospermii (zupełny brak plemników) [7].
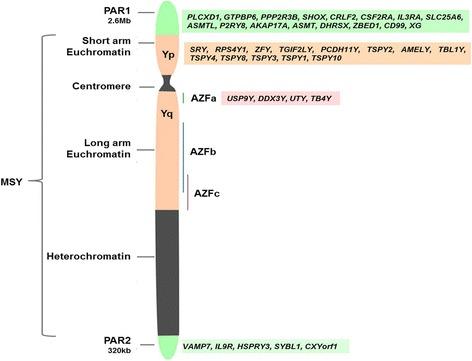
Ryc.1. Struktura ludzkiego chromosomu Y wraz z oznaczeniami wskazującymi na położenie poszczególnych podregionów AZF (zaznaczone na pomarańczowo) [5]. MSY (male specific region – region specyficzny dla mężczyzn) obejmuje 95% długości chromosomu Y oraz nie podlega rekombinacji z chromosomem X. Regiony PAR (ang. pseudo autosomal regions – z ang. regiony pseudoautosomalne) zaznaczone na zielono to krótkie fragmenty wykazujące homologię między chromosomami X a Y u ssaków które podlegają rekombinacji[5].
Każdy z podregionów zawiera geny związane z przebiegiem spermatogenezy niezbędne do jej prawidłowego przebiegu [1].
Fenotypy powiązane z delecjami w obrębie AZFa to azoospermia i zespół SCO (Sertoli cell only syndrome – zespół samych komórek Sertolego). W przypadku tego schorzenia brak jest męskich komórek płciowych w kanalikach nasiennych [1]. Jednym z genów znajdujących się w tym subregionie jest USP9Y, który może być odpowiedzialny za inhibicję proteolizy niektórych białek niezbędnych do spermatogenezy poprzez ich deubikwitynacje [8]. Jednakże funkcja pełniona przez ten gen prawdopodobnie nie jest niezbędna do przebiegu prawidłowej spermatogenezy gdyż u szympansów zwyczajnych i bonobo gen ten jest nieaktywny [9]. Drugi ważny gen DBY znajdujący się w tym regionie prawdopodobnie jest związany z zespołem SCO z racji swojej specyficznej ekspresji ograniczonej do jąder oraz zaangażowania w regulacje premejotycznych komórek płciowych [10].
Mikrodelecje w regionie AZFb (Ryc.2.) są związane z zatrzymaniem spermatogenezy na etapie spermatocytu I rzędowego. Prowadzą one również do azoospermii. Głównym genem tego subregionu jest gen RBMY odpowiadający za regulację splicingu w spermatogoniach, spermatocytach i spermatydach [1]. Splicing to proces, w którym dochodzi do wycięcia sekwencji intronowych (niekodujących) z pre-mRNA, co prowadzi do pozostawienia jedynie eksonów (sekwencji kodujących) które zostają przepisane na jedną ciągłą cząsteczkę mRNA gotową do translacji (biostyntezy białka). Ważnymi genami obecnymi w tej części chromosomu są te pochodzące z rodziny PRY. Regulują one apoptozę i w toku spermatogenezy przyczyniają się do usunięcia z populacji abnormalnych plemników.
W przypadku uszkodzeń podregionu AZFc (ryc. 2.) mamy do czynienia, z fenotypami które w wielu przypadkach związane są z niską koncentracją plemników w nasieniu w wyniku spadku efektywności spermatogenezy. W odróżnieniu do podregionów AZFa oraz AZFb, które są niezbędne do inicjacji spermatogenezy, delecje w podregionie AZFc uniemożliwiają jedynie jej prawidłowe zakończenie [6]. AZFc podlega wielu niewielkim delecjom które w zależności od uwarunkowań środowiska oraz czynników genetycznych mogą prowadzić do szerokiej gamy fenotypów poczynając od normozoospermii (standardowej ilości plemników, prawidłowych parametrów nasienia takich jak pH i objętość) poprzez oligozoospermię (obniżonej ilości plemników w nasieniu) do azoospermii (zupełnego braku plemników w nasieniu) [1]. Najważniejszymi genami obecnymi w tej części chromosomu są te z rodziny DAZ, które podlegają ekspresji przez cały proces spermatogenezy i odgrywają w nim szereg ról takich jak regulacja transkrypcji, kontrola mejozy, kodowanie białek wiążących RNA. Delecje w tym regionie mogą prowadzić w drastycznych przypadkach do azoospermii, zazwyczaj jednak delecje objawiają się azoospermią [1].
Mikrodelecje w regionie w regionie AZFd prowadzą najczęściej do łagodnej oligozoospermii (10-20 mln w 1 ml nasienia) i nieprawidłowej morfologii plemników.
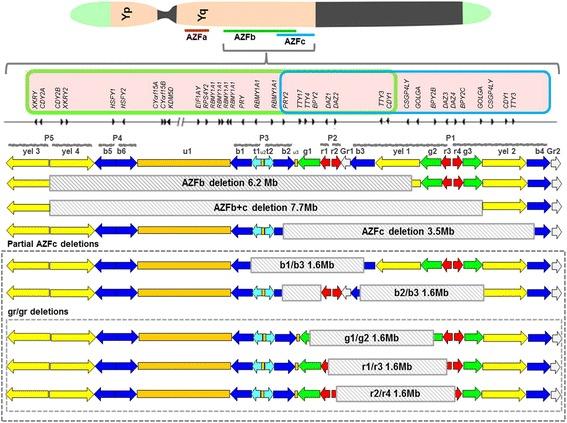
Ryc. 2 Niektóre z delecji możliwych w obrębie podregionów AZFb i AZFc [5].
Wykrycie tych przyczyn niepłodności męskiej – mikrodelecji w genie AZF prowadzących do azoospermii jest ważne, bo oszczędza parze dalszej diagnostyki i leczenia, które w takiej sytuacji nie ma szans powodzenia. W takim przypadku przyczynowe leczenie niepłodności na razie nie jest możliwe. W przypadku innych mutacji tego genu, np. w obrębie regionu AZFc, jeśli para akceptuje procedury zapłodnienia pozaustrojowego, to w niektórych sytuacjach może się udać ICSI.
Większość autorów jest zgodna co do faktu, że delecje w chromosomie Y, w szczególności w regionie AZF są jednymi z najważniejszych czynników zaburzających proces spermatogenezy, a tym samym przyczyniających się do niepłodności męskiej [14].
Literatura:
- O’Flynn O’Brien KL, Varghese AC, Agarwal A. The genetic causes of male factor infertility: a review. Fertil Steril. 2010 Jan;93(1):1-12. doi: 10.1016/j.fertnstert.2009.10.045. PMID: 20103481.
- Nailwal M, Chauhan JB. Azoospermia Factor C Subregion of the Y Chromosome. J Hum Reprod Sci. 2017 Oct-Dec;10(4):256-260. doi: 10.4103/jhrs.JHRS_16_17. PMID: 29430151; PMCID: PMC5799928.
- Repping S, Skaletsky H, Lange J, Silber S, Van Der Veen F, Oates RD, Page DC, Rozen S. Recombination between palindromes P5 and P1 on the human Y chromosome causes massive deletions and spermatogenic failure. Am J Hum Genet. 2002 Oct;71(4):906-22. doi: 10.1086/342928. Epub 2002 Sep 20. PMID: 12297986; PMCID: PMC419997.
- Ioulianos A, Sismani C, Fourouclas N, Patroclou T, Sergiou C, Patsalis PC. A nation-based population screening for azoospermia factor deletions in Greek-Cypriot patients with severe spermatogenic failure and normal fertile controls, using a specific study and experimental design. Int J Androl. 2002 Jun;25(3):153-8. doi: 10.1046/j.1365-2605.2002.00340.x. PMID: 12031043.
- Colaco S, Modi D. Genetics of the human Y chromosome and its association with male infertility. Reprod Biol Endocrinol. 2018 Feb 17;16(1):14. doi: 10.1186/s12958-018-0330-5. PMID: 29454353; PMCID: PMC5816366.
- Georgiou I, Syrrou M, Pardalidis N, Karakitsios K, Mantzavinos T, Giotitsas N, Loutradis D, Dimitriadis F, Saito M, Miyagawa I, Tzoumis P, Sylakos A, Kanakas N, Moustakareas T, Baltogiannis D, Touloupides S, Giannakis D, Fatouros M, Sofikitis N. Genetic and epigenetic risks of intracytoplasmic sperm injection method. Asian J Androl. 2006 Nov;8(6):643-73. doi: 10.1111/j.1745-7262.2006.00231.x. PMID: 17111067.
- French DB, Sabanegh ES Jr, Goldfarb J, Desai N. Does severe teratozoospermia affect blastocyst formation, live birth rate, and other clinical outcome parameters in ICSI cycles? Fertil Steril. 2010 Mar 1;93(4):1097-103. doi: 10.1016/j.fertnstert.2008.10.051. Epub 2009 Feb 6. PMID: 19200957.
- https://www.uniprot.org/uniprot/O00507#function
- Tyler-Smith C. An evolutionary perspective on Y-chromosomal variation and male infertility. Int J Androl. 2008 Aug;31(4):376-82. doi: 10.1111/j.1365-2605.2008.00889.x. PMID: 18399979; PMCID: PMC2628431.
- Vogt PH. Azoospermia factor (AZF) in Yq11: towards a molecular understanding of its function for human male fertility and spermatogenesis. Reprod Biomed Online. 2005 Jan;10(1):81-93. doi: 10.1016/s1472-6483(10)60807-3. PMID: 15705299.
- Kuroda S, Usui K, Sanjo H, Takeshima T, Kawahara T, Uemura H, Yumura Y. Genetic disorders and male infertility. Reprod Med Biol. 2020 Jun 27;19(4):314-322. doi: 10.1002/rmb2.12336. PMID: 33071633; PMCID: PMC7542010.
- Kent-First M, Muallem A, Shultz J, Pryor J, Roberts K, Nolten W, Meisner L, Chandley A, Gouchy G, Jorgensen L, Havighurst T, Grosch J. Defining regions of the Y-chromosome responsible for male infertility and identification of a fourth AZF region (AZFd) by Y-chromosome microdeletion detection. Mol Reprod Dev. 1999;53:27–41.
- Vineeth VS, Malini SS. A Journey on Y Chromosomal Genes and Male Infertility. Int J Hum Genet. 2011;11:203–215.
- Kamiński P, Baszyński J, Jerzak I, Brendan P. K, Nowacka-Chiari E, Polanin M, Szymański M, Woźniak A and Kozera W. External and Genetic Conditions Determining Male Infertility. Int. J. Mol. Sci. 2020, 21, 5274; doi:10.3390/ijms21155274.
ul. Juliana Tuwima 15 lok. U4
90-010 Łódź
© Centrum Medyczne Code 2021
Polityka prywatności
Projekty B+R
Pracownie
- Pracownia Parazytologiczna
- Pracownia Semiologiczna
- Pracownia Genomiki
- Pracownia Med.Molekularnej
